
技术文章
 更新时间:2011-08-15
更新时间:2011-08-15 点击次数:4770
点击次数:4770
利用细胞的特性[尺寸、密度、电特性、表面(抗原)性质,光散射特性等等]可以用各种方法分离和纯化细胞。离心分离是利用不同尺寸和密度的细胞在离心场中沉降行为的不同,从组织匀浆或血液中分离纯化的技术。用离心技术分离和纯化细胞主要依赖的方法是差分离心、速率-区带密度梯度离心、等密度离心和利用特殊转头的细胞浮选离心。
| 分离依据 | 方法名称 | 离心加速度 | 梯度形状 | 使用工具 | 局限性 | 优点 |
| 细胞密度 (ρ) | 平衡 等密 度离 心 | 比较高 (100 ~ 30,000 × g) | 连续或不连续 梯度 | 甩平转头,固定 角转头, 区带转 头 | 离心力较 大,等密度 纯样品区带 可能重叠 | 细胞易聚合;应用面较 面较广 |
| 沉降速度(细胞平 均直径d 密度ρ) | 差分离心 | 1 ~ 300 ×g | 无梯度 | 角式为主 | 低分辨率 | 快速,简易 |
| 单位重力 加速 度沉 降 | 1g | 连续梯度 | 特殊分离容器 | 容量50 × 106个细胞, 特殊装备, 时间长 | 简单,价廉 | |
| 速率 -区 带离 心 | 20 ~ 1 , 000×g | 连续梯度,线性 或等速度沉降 梯度,ρ梯度介 质≤ρ细胞 | 甩平转头或区带 转头 | 中等分辨 率,容量范 围宽 | 大容量用区带转 头,小容量用甩平 转头,后者操作简 单 | |
| 离心 浮选 | 100 ~ 3,000×g | 无梯度 | 细胞浮选转头 ( 日立或 Beckman) | 装置费用高 | 快速,高分辨率, 处理量较大 |
沉降速度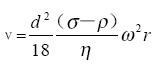 ,ν的单位是(厘米/秒)
,ν的单位是(厘米/秒)
| i. | 用抗凝血剂处理血样,常用抗凝剂为0.32%柠檬酸钠。 |
| ii. | 用等容积的生理盐水稀释血样。 |
| iii. | 在10ml~15ml 离心管中先注入3ml metrizoate-Ficoll 分离液,在其上铺6ml 已稀释 |
| | 血样。 |
| iv. | 用甩平转头600g(1,800~3,000ropm,台式机)×20 分,20℃。( 不要在4—5℃低 |
| | 温离心,否则分离效果将很差。 |
| v. | 离心后用巴氏移液吸管从血浆与分离液界面中间吸出血细胞层,其中含有单核(白) |
| | 细胞和部分血小板。 |
| vi. | 加入几毫升生理盐水,降低收集的血细胞浓度。 |
| vii. | 同一离心转头,同一离心管250g(1200rpm 左右)×5 分钟20℃。可以用同一工 |
| | 艺在离心机中洗几次。 |
| viii. | 收集沉淀在生理盐水中保存。 |
| 名称 | 成分 | 用途 | 生产商 |
| Lymphoprep | 9.6%Na-metrizoate, 5.6% Ficoll | 单核细胞分离 | Nycomed-pharma |
| Ficoll-page | 9.6 Na-diatrizoate 5.6% Ficoll | 单核细胞分离 | Pharmacia-Biosy-st ems |
| Nycoprep 1.077 | 14.1% Nycodenz 0.44% Nacl | 单核细胞分离 | Nycomed-pharma |
| Nycoprep mixer | 19.0% Nycodenz 0.2% Nacl | 单核细胞分离 | Nycomed-pharma |
| Nycoprep 1.068 | 13.0% Nycodenz 0.58% Nacl | 单核(白)细胞淋巴细胞分离 | Nycomed-pharma |
| Nycoprep 1.063 | 12.0% Nycodenz 0.58% Nacl | 血小板分离 | Nycomed-pharma |
| Mono-poly Resolving medium | 15.5% Na-diatrizoate 8.18% Ficoll | 多形核细胞分离 | Flow-Laboratories |
| Polymorphprep | 13.8% Na-metrizoate 8.0% Dextran 500 | 单核细胞中性白细胞红细胞分离 | Nycomed-pharma |
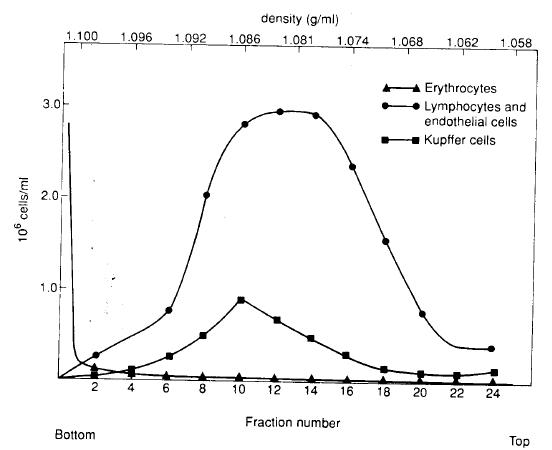
| 项目 | Nycodenz | metrizamide | |
| 细胞产率 | 43×106 | 44×106 | |
| 细胞活力 | 99% | 99% | |
| 细胞化学染色 | 过氧化物酶染 | 17% | 27% |
| 酯酶染 | 71% | 80% | |
| 细胞组成: | Kupffer | 16% | 26% |
| endothelial | 54% | 54% | |
| 储脂细胞 | 10% | 1% | |
| 红细胞 | 1% | 1% | |
| 主质细胞 | 1% | 1% | |
| 其他细胞(如淋巴细胞) | 18% | 18% | |
| 细胞名称 | | 细胞组成 | | |
| 低密度片断 | | 高密度片断 | | |
| | 细胞数量(×106) | % | 细胞数量(×106) | % |
| 储脂细胞 | 52.5 | 79.6 | 0.9 | 0.4 |
| Kupffer | 0.7 | 1.0 | 45.5 | 20.3 |
| endothelial | 10.9 | 16.6 | 129.7 | 57.9 |
| 其他细胞(如淋巴细胞) | 1.9 | 2.8 | 47.9 | 21.4 |
| 总计 | 66 | 100 | 224.0 | 100 |
| 细胞样品 | 被分离细胞类型 | 梯度 | 离心时间 /RCF( × g) | 设备 | 结果 | | 文 献 | |
| 纯度 | 产率 | 活力 | ||||||
| 白血球 | 淋巴细胞(a) 单核细胞(b) | BSA(1.5~6.5%) | 9 分/20× g | 特制离心室 | a) > 90% b) ~ 90 % | a)90% b)67% | 99% | 5 |
| 白血球 | 淋巴细胞(a) 单核细胞(b) | Ficoll(2~4%) | 2 小时/1g | 重力沉 降室 | a) - b)69 ~ 77% | a) - b) 28% | >98 % | 12 |
| 白血球 | 淋巴细胞(a) 单核细胞(b) | Ficoll ( 3.4 ~ 16.9%) | 45 分/800 ×g | 低速区带转头 | / | / | / | 12 |
| 预处理白血球 | 淋巴细胞(a) 嗜碱性细胞(b) | Ficoll(4.5~9.5 %) | 15 分/85 ×g | 甩平转头100ml 离心管 | a) > 95% b)62 ~ 72% | a) > 90% b)30 ~ 50% | / | 11 |
| 人骨髓细胞 | CFU-C | Ficoll(2~4%) | 2h/1g | 重力沉降室 | / | / | / | / |
| 预处理的犬胃 细胞 | 壁细胞(a) 主细胞(b) | Ficoll(2~4%) | 50 分/1g | 重力沉 降室 | a) > 60% b) 85% | a) ~ 50% b) ~ 30% | / | 12 |
| 窦状肝细胞 | Kupffer(a) Endothelial(b) | Percoll (3.5~18%) | 8 分/16g | 特殊沉降室 | a) 98% b) 97% | a) 68% b) 86% | >95 % | 5 |
| | ||||||||
| 二倍体(2n) | 四倍体(4n) | 八倍体(8n) | 16 倍体(16n) | |||
| 单核 | 双核 | 单核 | 双核 | 单核 | 双核 | / |
| 9% | 16% | 53% | 16% | 4% | 2% | |
| 成分 | 流量ml/min | 细胞数量×106 | 活性(%) | 组成 |
| 原液 | | 137.8 | 84 | 2n,4n,8n,16n 及少量细胞聚集团及细胞碎片 |
| I | 19 | 39.8 | 72 | 2n,4n, 少量细胞碎片 |
| II | 32 | 54.7 | 85 | 4n(90%) |
| III | 41 | 15.5 | 83 | 4n,8n,细胞聚集团 |
| 沉淀 | | 17.1 | 82 | 同原液数据 |
| 混合室 | | 5.2 | 85 | 同原液数据 |
| 总数 | | 127.0(92%) | | |
| i. | 用不连续Nycodenz 梯度制备鼠肝Sinusoidal 细胞悬液(参见本文前例) |
| ii. | 安装离心浮选系统(Hitachi 或Beckman) |
| iii. | 标准离心室:3,250rpm,4℃ |
| iv. | 初始流量13.5ml/min 注入1~5×108个细胞悬液 |
| v. | 在流量分别为18,32,48ml/min 时分别收集100ml,150ml,150ml |
| | 收集液中含有白细胞(L)、星形细胞(K)、内皮细胞(E)及主质细胞(P),收集 |
| | 液保存在4℃。 |
| vi. | 离心后收集在浮选室中的细胞 |
| vii. | 各种收集液离心沉淀:450g×10 分,沉淀分别混悬于3mlGBSS 中 |
| 成份 | 细胞主要类型 | 细胞总量×106 | 活性 | 染色细胞比例% | 组成% | | |||
| | | | % | P1 | E1 | P | L | E | K |
| 初始细胞液 | Sinusoidal | 167.4 | 87 | 24.7 | 86.8 | 0.6 | 13.2 | 61.5 | 24.7 |
| I 收集液(100ml) | L | 19.9 | 80 | 3.0 | 28.6 | / | 71.4 | 25.6 | 3 |
| II 收集液(150ml) | E | 82.5 | 95 | 9.0 | 89.2 | / | 10.8 | 80.2 | 9 |
| III 收集液(150ml) | K | 34.7 | 97 | 83.5 | 95.1 | / | 4.9 | 11.6 | 83.5 |
| 沉淀 | 细胞聚集团 | 9.8 | 95 | 34.5 | 96 | 16.0 | 4.0 | 44.6 | 35.4 |
| i. | 离心浮选设备(同上) |
| ii. | 转速3,250rpm,4℃,流量16ml/min |
| iii. | Sinusoidal 细胞制备参照前述二阶不连续梯度离心法。 |
| iv. | 加样:5~50×107 个细胞注入混合室 |
| v. | 用16ml/min 及18ml/min 分别收集二次,zui后收集在离心室中剩下的细胞液 |
| vi. | 以上三种收集液分别450g×10 分钟离心,收集沉淀后分别用2mlGBSS 混成 |
| | 悬液 |
| 成份 | 细胞主要类型 | 细胞总量×106 | 活性% | 染色细胞比例% | | 组成% | | ||
| | | | | P | E1 | F | L | E | K |
| 初始样品 | E.F | 133 | 94 | 8 | 98 | 16 | 2 | 75 | 8 |
| F1 | F | 14 | 80 | 1 | 88 | 78 | 12 | 9 | / |
| F2 | F | 6 | 85 | 1 | 94 | 53 | 6 | 40 | / |
| 沉淀 | E | 108 | 93 | 1 | 99 | 7 | / | 81 | 11 |
| i. | 用例(1) 的方法从50ml 血样中纯化单核细胞,从分界面收获细胞液, 加浮选 |
| | 液后容积为5ml 。 |
| ii. | 安装离心浮选系统,用浮选液充满浮选离心室,设置5℃。 |
| iii. | 预置转速2,030rpm, 设定流量4.7ml/min |
| iv. | 加入样品(1×108 个细胞), 离心,分九次收集,每次50ml 分别用流量4.7,8.0, |
| | 10.0,11.0,12.0,12.7,13.5,14.5,16ml/min 收集。 |
| v. | 收集后的细胞样品分别用450g×10 分收集沉淀。 |
| vi. | 将以上沉淀分别用3ml 浮选液稀释成悬液 |
| vii. | Esterrase 染色后计数 |
| | 结果如下表: |
| 成份 | 流量(ml/min) | 细胞数量(×106) | 酯酶染色 | |
| 负染(%) | 正染(%) | |||
| 原液 | / | 104 | 85.6 | 14.4 |
| 1 | 4.7 | 0 | / | / |
| 2 | 8.0 | 3 | 100 | 0 |
| 3 | 10.0 | 17.8 | 99.7 | 0.3 |
| 4 | 11.0 | 25.0 | 99.3 | 0.7 |
| 5 | 12.0 | 25.0 | 98.0 | 2.0 |
| 6 | 12.7 | 10.8 | 95.2 | 4.8 |
| 7 | 13.5 | 1.2 | 95.3 | 4.7 |
| 8 | 14.5 | 0.8 | 84.5 | 15.5 |
| 9 | 16 | 2.0 | 58.7 | 41.3 |
| 沉淀 | / | 10.0 | 28.4 | 71.6 |